[화학] Ch. 10.2 작용기 반응 (Functional Group Chemistry) 파트 1
이 단원에서는 유기화합물들이 반응할 수 있는 다양한 메커니즘에 대해서 배웁니다.
가장 먼저 다루는 반응은 10.1에 등장했던 동종 계열 중 하나인 알케인이 하는 반응입니다.
알케인은 앞서 포스팅에서 다뤘다시피 연료로도 사용됩니다. 연료로 사용될 때의 반응은 다음과 같습니다.
CnH2n+2 + O2 → CO2+ H2O
하지만 이런 반응 외에도, 알케인은 유리기 치환 반응, 혹은 자유 라디칼 치환 반응(free radical substitution,SR)이라는 반응을 할 수 있습니다. 자유 라디칼 치환 반응은 할로젠이 자외선과 반응하여 라디칼을 생성하고, 이 라디칼이 알케인과 반응하는 반응입니다. 라디칼은 최외곽 전자(outer shell electron) 중에 짝이 없는 전자, 즉 전자가 홀수개가 있으면 라디칼입니다. 짝이 없는 전자는 비결합 전자쌍(lone pair) 과는 다르게, 짝이 없습니다. 그러므로 짝을 찾으려고 하고 높은 반응성을 지닙니다. 이렇기 때문에 비교적 안정한 알케인과도 반응할 수 있습니다. 치환 반응은 총 3가지의 단계: 개시 단계(Initiation), 전파 단계(Propagation), 종결단계(Termination)로 이루어집니다.
첫 번째 단계인 개시단계(initiation)의 예시는 다음과 같습니다.
Cl2(g) → 2Cl•(g)
예시에서는 하나의 염소(Chlorine) 분자가 두 개의 염소 라디칼로 쪼개지는 반응이 나와있습니다. 공식에는 나와있지 않지만, 이 반응은 Bond-Breaking이므로 Endothermic이며, 반응을 하기 위해서는 에너지가 필요합니다. 이 에너지는 보통 자외선(UV)이 가해짐으로 공급됩니다. 또한, 하나의 분자가 두 개의 같은 라디칼로 쪼개졌으므로 동형 분열(Homogeneous fission)입니다. 만약 두 개의 다른 라디칼로 쪼개졌다면 이형 분열(Hetrogeneous fission)일 것입니다.
두 번째 단계인 전파 단계(propagation)의 예시는 다음과 같습니다.
CH4(g) + •Cl(g) → CH3•(g) + HCl(g)
CH3•(g) + Cl2(g) → CH3Cl(g) + Cl•(g)
이 반응이 어떠한 원리로 더 자세히 알아보기 위해서는 전자의 이동을 파악해야 합니다.

위의 그림에서 빨간색 화살표는 전자의 이동을 나타냅니다. 먼저 첫 번째 과정에서 메탄 분자에 붙어있는 수소원자가 공유되어있던 전자 하나를 가지고 떨어져, 염소 라디칼과 반응을 해, 메틸 라디칼과 염화수소를 만듭니다. 여기서 생성된 메틸 라디칼은 다시 또 주변에 있는 다른 염소 분자와 반응해, 염화메탄(chloromethane)과 염소 라디칼을 만듭니다. 염소 라디칼은 처음 반응과 끝 반응 모두에 존재하고, 반응을 더욱 빠르게 만드는, 전형적인 촉매(Catalyst)라고 할 수 있습니다.
이렇게 염소 라디칼이 소모되지 않고 계속 존재하기 때문에, 자유 라디칼 치환반응은 약간의 개시자(radical initiator, 이 경우에는 염소 라디칼)만으로도 종결단계 전까지 지속적으로 반응할 수 있습니다. 이는 약간의 오존층 파괴 물질로도 심각한 오존층 파괴가 일어나는 이유이기도 합니다. Chapter 14.1에서 다뤘듯이, 이 경우에는 CFC(Chlorofluorocarbon)이나 질소 산화물(NOx)이 오존을 산소로 분해하는 반응에 대해 다룹니다. 더 자세한 내용은 ([화학]Chapter 14.1 공유 결합 및 구조의 심화(further aspects of covalent bonding and structure))를 참고해 주시기 바랍니다. (링크 추가 예정)
물론 염소 라디칼이 소모되지 않고 영원히 반응하는 것은 아닙니다. 세번째 단계인 종결단계(Termination)에서는 라디칼들끼리 반응하여, 더 이상 반응이 일어나지 않게 됩니다.
CH3•(g) + CH3•(g) → CH3CH3(g)
CH3•(g) + Cl•(g) → CH3Cl(g)
Cl•(g) + Cl•(g) → Cl2(g)
종결단계는 그냥 라디칼들끼리 반응하는 식을 그려주면 됩니다.
이로써 알케인의 반응은(적어도 IB 교육과정 내에서는) 끝입니다.
다음으로는 알켄(Alkene)의 반응을 다뤄보겠습니다. 자유 라디칼 치환 반응만을 다루는 알케인과는 다르게 알켄은 조금 더 다양한 종류의 반응들이 있습니다. 처음으로 다뤄볼 반응은 친전자성 첨가 반응(Electrophilic Addition,AE)입니다. 기본적으로 친전자성 첨가 반응은 다음과 같은 식을 가집니다.
CnH2n + XY → CnH2nXY
여기서 XY는 친전자체(Electrophile)로, 할로젠, 할로젠화물, 물, 수소 등이 될 수 있습니다. XY가 무엇이냐에 따라 반응 과정과 사용하는 촉매 등이 다릅니다. 이를 한 번에 정리한 그림을 아래에 첨부하였습니다.
HL 학생들을 위해 추가로 설명하자면, 친전자체는 전자가 부족하기 때문에(electron deficient) 전자, 더 자세히는 전자쌍(lone pair)을 원합니다. 그러므로, π-전자가 풍부한 이중결합에 이끌려 이중결합을 끊고 이 자리에 들어갑니다. 이에 관해 더 자세한 내용은 ([화학]14.2 혼성화(Hybridization)을 참고해 주시기 바랍니다. (링크 추가 예정) 또한, 8단원의 HL파트에서 다뤘다시피, 전자를 받아들이는 물질(electron pair acceptor)는 루이스 산(Lewis acid)입니다. 친전자체 또한 전자를 받아들이므로 루이스 산으로 분류됩니다. 더 자세한 내용은 ([화학]18.1 루이스 산과 염기(Lewis acid and bases))를 참고 바랍니다.(링크 추가예정)

그림에 나와있다시피, 수소를 첨가하는 반응은 수소화 반응(Hydrogenation)이라고 하고, 알켄에 수소와 니켈 촉매를 더하여 이중결합을 끊고 알케인을 만듭니다.

다음으로는 할로젠을 첨가하는 할로젠화 반응(Halogenation)입니다. 말 그대로 할로젠을 첨가하여 이할로젠화알케인(dihalogenoalkane)을 만듭니다. 이 반응은 특별한 촉매가 필요 없습니다.

다음으로는 할로젠화물(Halide, 수소와 할로젠이 결합한 화합물)을 첨가하는 할로젠화물 첨가 반응(Addition of Halide)입니다. 이 반응의 생성물은 할로젠화알케인(halogenoalkane)입니다. 이 반응 또한 특별한 촉매가 필요 없습니다.

마지막으로는 물을 첨가하는 수화 반응(Hydration)입니다. 알켄에 물과 진한 황산을 촉매로 첨가하여 알코올을 생성합니다. 영칭인 Hydration이 수소화 반응인 Hydrogenation과 비슷하니 혼동하지 않도록 주의합니다.

이렇게 알켄의 4가지 친전자 첨가 반응에 대해 알아보았습니다. 이중 특별히 중요하게 다루는 반응이 있는데, 이는 할로젠화 반응, 그중에서도 브로민(Bromine) 첨가 반응입니다. 브로민은 상온에서 갈색을 띠는 액체입니다. 이 브로민을 함유하고 있는 브롬수(Bromine water)를 알켄과 반응하게 되면 이브롬화알케인이 되며, 색이 무색으로 바뀌게 됩니다. 이를 통해 알켄, 더 나아가 이중결합의 존재를 알 수 있습니다. 이는 알켄과 같은 일반식을 가지는 사이클로알케인과 구분되는 특징입니다. (사이클로알케인은 브로민과 반응하지 않습니다.) 이 브로민과 알켄의 반응은 Bromine Test라고 해서 시험에 알켄의 구분 방법 등으로 자주 출제되니 기억해 두는 것이 좋습니다. (추가로, 브로민의 색상이 생각나지 않을 때는 영어 이름을 생각해보세요. Bromine ↔ Brown)
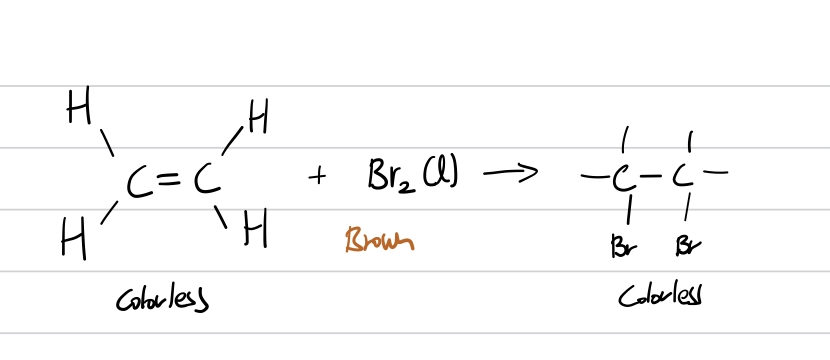
추가로, 알켄의 친전자 첨가 반응에는 한 가지 종류가 더 있습니다. 이는 폴리머화 반응(Polymerization)입니다. 이 반응은 조금 특이한데, 같은 알켄들끼리 반응해 기다란 사슬을 이룹니다. 사슬을 이루기 전 단일 분자는 단량체(monomer), 사슬을 이루고 난 후는 중합체(고분자, Polymer)라고 합니다. 이중결합이 끊어져 사슬을 이루기 때문에, 사슬에는 이중결합이 없습니다.
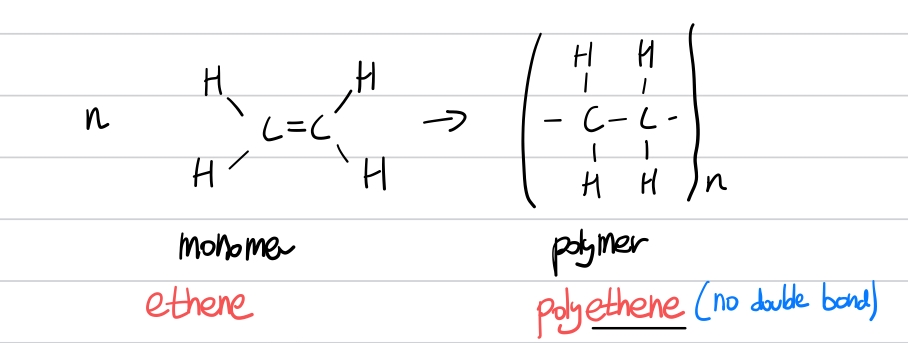
우리가 평소에 흔히 볼 수 있는 플라스틱이 대표적인 고분자 물질입니다. 한 번쯤은 들어봤을 PVC, 스티로폼, 폴리에틸렌 등이 모두 화학식을 줄이거나 그대로 적은 것입니다. 위의 예시에 나와있는 물질이 바로 폴리에틸렌입니다. 에텐의 일반명(common name)은 에틸렌(ethylene)이고, 고분자 구조는 폴리에틸렌입니다.

이 반응에서 단량체의 IUPAC이름은 chloroethene이지만, 일반명은 vinyl chloride이기 때문에 고분자 구조를 이루면 polyvinyl chloride, 즉 PVC가 됩니다.

단량체의 이름은 스티렌(Styrene), 중합체의 이름은 폴리스티렌입니다. 이를 발포(내부에 거품/구멍을 만드는 과정)를 통해 가볍고 부피가 크게 만들어주면 발포 스티렌, 혹은 스티로폼이 됩니다.
참고로 여기서 다룬 분자들과 이름, 일반명과 반응은 교육 과정의 일부가 아니고, 평소에 볼 수 있던 플라스틱들의 반응을 살펴보아 이해를 돕기 위함이니 외울 필요는 없습니다. 하지만 교육과정에 공식적으로 나오는 반응은 첫 번째 반응인 에텐의 폴리머화지만, 다른 반응들도 반응물이나 생성물의 이름을 묻지 않을 뿐 출제는 될 수 있으니 알아두어서 나쁠 것은 없습니다.
이제 SL 파트에서 다루는 알켄의 반응에 대해서 모두 살펴보았으니, 예제 문제를 살펴보겠습니다.
예제 문제
1) State and explain the method of distinguising following compounds with same molecular formula chemically.
동일한 분자식을 가지는 다음 두 분자를 화학적으로 구분할 수 있는 방법을 말하고, 그에 대해 서술하시오.

2) Which describes the reaction between halogen and ethane?
할로젠과 에텐의 반응을 올바르게 서술한 것을 고르시오.
| 기전(Mechanism) | 할로젠 내부 결합분열 방식 (Bond fission in halogen) | |
| A. | 자유 라디칼(free radical) | 동형 분열(Homolytic) |
| B. | 자유 라디칼(free radical) | 이형 분열(Hetrolytic) |
| C. | 첨가(Addition) | 동형 분열(Homolytic) |
| D. | 첨가(Addition) | 이형 분열(Hetrolytic) |
3) Which monomer is used to form the polymer with following repeating unit?
다음 중합체를 형성하는 올바른 단량체를 고르시오

A. CH3CH=CHCH3
B. CH3CH2CH=CH2
C. CH3CH2CH3
D. (CH3)2C=CH2
문제에 사용된 간략구조식이 이해가 되지 않는다면 이 포스팅을 참조해 주세요.
-----------------------------------------------------------------------------------------------------------------------------------
답)
1) (1번 분자 - hex-1-ene, 2번 분자 - cyclohexane)
브로민 시험, 브롬수를 알켄과 반응시키면 친전자 첨가 반응으로 인해 색이 갈색에서 무색으로 변함. 그러므로 첫 번째 분자는 색 변화가 있으나 두 번째 분자는 이중결합이 없기에 반응이 없고 색 변화도 없을 것임.
Bromine test, reacting bromine water with alkene changes the color of the solution from brown to colorless due to electrophilic addition. Therefore, the adding bromine water to first compound will change the color. On the other hand, second compund does not include double bond and will not react with bromine water.
2)
A. 에텐은 이중결합이 없으므로 첨가 반응 X. 할로젠은 이분자 구조(bimolecular)/같은 두 개의 원자가 결합 → 두개의 같은 분자로 쪼개짐(homolytic fission)
3)
A.

가운데에 있는 이중결합이 끊어져 폴리머가 됩니다.
다음으로는 알코올의 산화 반응에 대해 알아보겠으나, 포스팅이 너무 길어지는 관계로 다음 포스팅에서 마저 다루겠습니다.
읽어주셔서 감사합니다. 한국어 번역이나 문법이 어색한 부분이 있을 수 있습니다. 혹시나 오류를 발견하시거나 피드백이 있으시다면 댓글로 남겨주세요!