[화학] Ch. 10.2 작용기 반응 (Functional Group Chemistry) 파트 2
이 포스팅은 저번 포스팅에서 이어집니다. 저번 포스팅은 이곳을 참고해주세요.
저번 포스팅에 이어서 알코올의 산화반응에 대해 알아보겠습니다. 알코올은 알케인과 마찬가지로 산화될 수 있습니다. 하지만, 알케인과는 다르게 알코올에는 이미 산소 원자 하나가 존재하고, 이 때문에 분자가 이미 산화되어 있기 때문에 알케인의 산화보다 에너지를 덜 방출합니다(=less exothermic). 그러므로 알코올의 산화 반응은 그냥은 잘 일어나지 않습니다. 여기서 산화 반응은 타는 것(Combustion)과는 좀 다른데, 알코올도 불을 붙이면 잘 타지만, 이는 이 포스팅에서 다루는 알코올의 산화와는 같은 반응물이 들어가지만 다른 생성물이 나옵니다.
유기화학에서 다루는 알코올의 산화는 산화제(Oxidizing agent)를 사용합니다. 알코올의 산화는 대부분 산성화된 이크롬산칼륨/중크롬산칼륨(Acidified Potassium Dichromate, K2Cr2O7)을 사용합니다. 이 분자에서 중요한 역할을 하는 것은 이크롬산 이온이므로, 칼륨 이온에 대해서는 크게 신경 쓰지 않아도 됩니다. 산성화 되었다는 뜻은 산성 용액과 함께 반응시킨다는 의미입니다. 보통 황산(Sulfuric Acid, H2SO4)와 함께 반응시키지만, 식에서는 그냥 H+로 표현해주면 됩니다.
아래는 이크롬산칼륨을 사용해 에탄올을 산화시키는 반응입니다.

보다시피, 에탄올이 산성화 된 이크롬산 이온과 반응하면 에탄알(아세트 알데하이드, Ethanal/Acetaldehyde)로 산화되는 것을 알 수 있습니다. 에탄알 분자에 있는 산소 원자의 개수와 탄소 원자의 개수는 에탄올과 똑같지만, 수소의 개수가 두 개 더 적습니다. 수소를 잃는 것은 산화이므로(9단원 링크 추가 예정) 에탄올에서 에탄알로 변하는 것은 산화입니다.
그렇다면 에탄알을 또 한 번 산화시키면 어떻게 될까요? 아래의 반응식은 에탄알을 산화시키는 반응입니다.
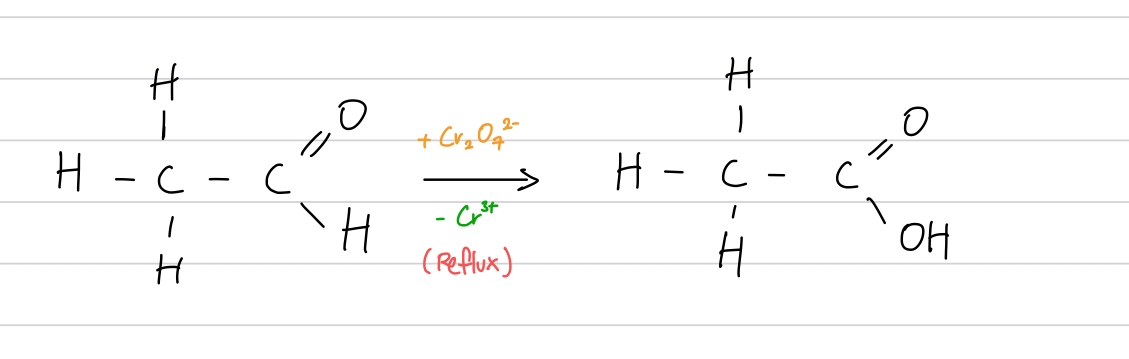
보다시피 에탄알을 또 한 번 이크롬산 이온과 반응시키니 에탄산(아세트산, Ethanoic Acid/Acetic Acid)로 산화되었습니다. 에탄산은 에탄알과 탄소 원자의 개수와 수소 원자의 개수는 같지만, 산소 원자가 하나 더 있으므로 산화입니다. 에탄산은 더 이상 산화될 수 없습니다.
알코올의 산화반응에서 또 눈여겨봐야하는 것은 크롬 이온의 색입니다. 두 반응 모두 반응을 하기 전의 크롬 이온, 이크롬산 이온은 주황색이지만, 반응을 한 후에는 3가 크롬 이온(Cr3+)로 변하고, 색도 초록색으로 변하게 됩니다. 이를 외우는 방법은 오렌지색에서 그린 색으로 변한다고 해서 오글오글이라고 외우거나, Orange to Green으로 외우면 되겠습니다.
10.1 단원에서 알아보았다시피, 알코올은 하이드록시기가 붙어있는 탄소에 붙어있는 탄소의 개수에 따라 1차, 2차, 3차(Primary, Secondary, Tertiary)로 분류할 수 있습니다.

이 알코올이 몇차 알코올이냐에 따라서 알코올의 산화 반응의 생성물이 달라집니다. 위에서 소개했던 에탄올은 1차 알코올이고, 1차 알코올은 산화되면 먼저 알데하이드가 되고, 이 반응을 위해서는 증류(distillation)가 필요합니다. 증류 과정은 아래와 같이 일어납니다.
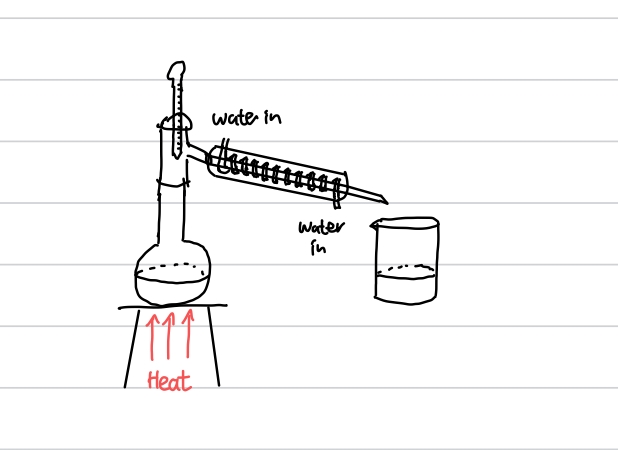
1차 알코올을 이크롬산 이온과 함께 가열하면 알데하이드 증기가 생성되고, 이 증기를 냉각 기구를 통해 액체로 응축시키면 액체 알데하이드를 얻을 수 있습니다.
알데하이드를 카복실산으로 바꾸기 위해서는 증류가 아닌 환류 Reflux) 과정이 필요합니다. 환류는 증류와 비슷하지만, 응축된 액체가 다시 반응물(알데하이드)로 돌아가게 됩니다. 이는 생성물을 액체로 유지하면서도 계속 열을 가할 수 있게 합니다.

2차 알코올은 1차와 다르게 산화를 시키게 되면 케톤이 생성물로 나오게 됩니다. 케톤과 알데하이드의 구조를 비교해 보면, 카보닐기(RCOR)는 둘 다 가지고 있고, 알데하이드는 두 개의 알킬기 대신 하나의 알킬기와 수소가 붙어있는 것을 확인할 수 있습니다.

1차 알코올은 하나의 알킬기가 있는 알데하이드가 생성물, 2차 알코올은 두개의 알킬기가 있는 케톤이 생성물이라고 기억하면 되겠습니다.
2차 알코올이 산화된 생성물인 케톤은 더 이상 산화될 수 없습니다.
3차 알코올도 비슷하게, 아예 산화될 수 없습니다.
결론적으로, 한눈에 1,2,3차 알코올의 산화 과정을 정리하면 아래와 같습니다.
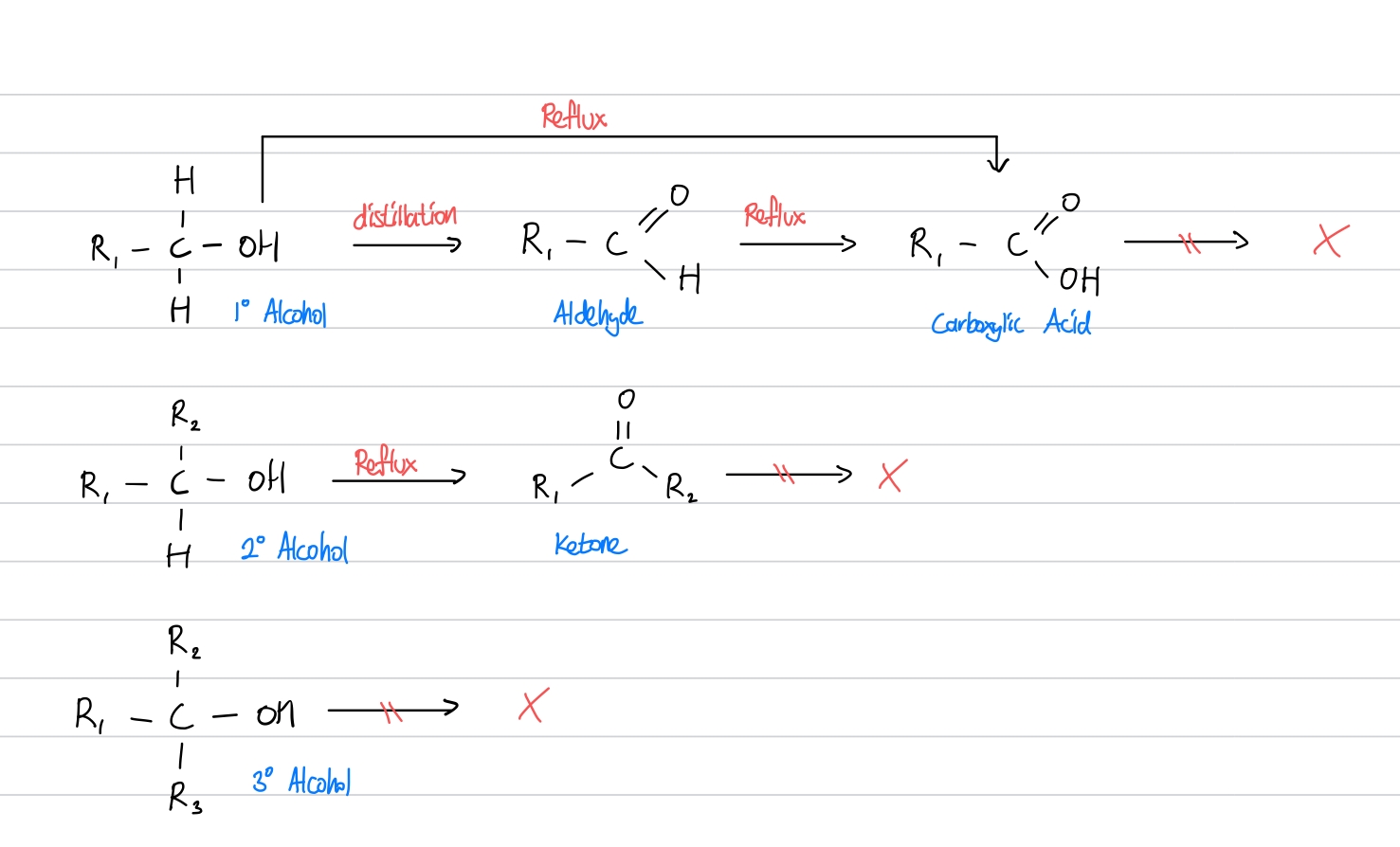
알코올의 산화반응을 알아봤으니, 다음으로는 친핵성 치환반응(Nucleophilic substitution, SN)에 대해 알아보겠습니다. 친핵성 치환반응은 보통 할로젠화 알켄과 수산화 이온(Hydroxide)의 반응을 예시로 들지만, 수산화 이온이 아닌 암모니아와 같은 친핵체의 반응 또한 알아두면 좋습니다.
친핵성 치환반응은 할로젠화 알켄이 1차, 2차, 3차냐에 따라 반응의 기전이 달라집니다. 먼저 SN1 반응에 대해 알아보겠습니다.

SN1 반응에서는 할로젠화 알켄이 스스로 분열하여 반응을 합니다. 여기서 할로젠화 알켄은 할로젠 이온과 탄소 양이온 중간물 (Carbocation intermidiate)으로 이종 분열(Hetrolytic fission)을 합니다. 반응의 첫 번째에 한 개의 분자가 있으니까 SN1이라고 기억하면 되겠습니다. 이에 대한 더 정확하고 자세한 설명은 HL 16.1 포스팅 (링크 추가 예정)/HL 20.1 포스팅을 참고해주세요.

SN2 반응에서는 친핵체가 직접 할로젠화 알켄을 공격하여 반응을 합니다. 그러므로, 반응이 시작되기 위해서는 친핵체와 할로젠화 알켄 두개의 분자가 필요합니다. 두 개의 분자가 필요하기 때문에 SN2라고 기억하면 되겠습니다.
반응이 SN1 반응일지 SN2 반응일지는 할로젠화 알켄이 몇차냐에 따라 달라집니다. 1차 할로젠화 알켄은 SN2 반응이 주로 일어나며, 2차 할로젠화 알켄은 SN1, SN2 반응이 비슷한 비율로 일어나고, 3차 할로젠화 알켄은 SN1 반응이 주로 일어납니다. 이를 기억하는 방법은 할로젠화 알켄의 차수와 작용기전의 숫자가 다르다고 기억하면 됩니다. (1 º RX → sN2, 3 º RX → Sn1) 그리고 2차 할로젠화 알켄은 1과 3의 사이임으로 SN1, SN2 둘 다 일어난다고 기억하면 되겠습니다.
마지막으로 벤젠의 구조와 특징에 대해 알아보겠습니다. 벤젠은 C6H6의 화학식을 가지고, 고리 모양의 구조를 가지고 있습니다. 고리 모양의 구조는 사이클로알케인(cycloalkane)에서도 찾아볼 수 있는 특징이지만, 벤젠은 사이클로알케인과는 구별되는 특징을 가지고 있습니다.

사이클로헥세인은 골격식으로 그릴 때는 보통 정육각형 모양으로 나타내지만, 실제로는 정육각형도 아니고 평면도 아닙니다.

하지만 이와 다르게 벤젠은 실제로 정육각형 모양이며, 평면입니다. 이는 벤젠이 가지고 있는 공명 구조(Resonace Structure)가 구조를 안정화시켜, 탄소 간의 모든 결합이 같은 길이와 힘을 가지게 하기 때문입니다. 이는 벤젠이 굉장히 안정적인 물질인 이유입니다.
벤젠은 안정적이기 때문에 일반적인 알켄과 다르게 첨가반응이 일어나지 않습니다. 벤젠에 있는 이중결합은 안정한 상태기 때문에 결합을 끊고 싶지 않아 하기 때문입니다. 이 때문에 벤젠에서는 친전자 치환 반응(Electrophilic Substitution)만이 일어납니다.

친전자 치환반응의 예로는 벤젠의 나이트로화 반응(Nitration of benezene)이 있습니다.

벤젠의 공명 구조를 보여주는 또 다른 특징으로는 1,2 - disubstituted benzene은 하나의 이성질체를 가진다는 사실과 Cyclohex-1,3,5-triene 보다 수소화 엔탈피의 발열량이 더 적다는 사실이 있습니다. 먼저, 1,2-disubstituted benzene은 1번 탄소와 2번 탄소에 수소 대신 다른 물질이 결합된 모습입니다. 벤젠이 공명 구조를 가지지 않았더라면, 1,2-disubstitued benzene은 아래와 같이 두 개의 이성질체가 존재해야 합니다.

하지만 벤젠은 공명 구조를 가지므로, 위의 두 물질은 같은 물질이며, 하나의 이성질체만이 존재합니다.
다음으로, Cyclohex-1,3,5-triene은 벤젠과 비슷한 구조를 가지지만, 공명구조가 존재하지 않습니다. Cyclohexene, Cyclohex-1,3-diene, Cyclohex-1,3,5-triene과 벤젠에 수소를 첨가해 사이클로헥세인으로 만드는 반응의 수소화 엔탈피를 살펴보면 다음과 같습니다.

벤젠이 공명 구조를 가지지 않았다면 Cyclohex-1,3,5-triene만큼의 에너지를 방출했겠지만, 공명 구조 때문에 실제로는 Cyclohex-1,3-diene보다도 적은 에너지를 방출하게 됩니다. 이는 벤젠의 구조가 Cyclohex-1,3,5-triene보다 더욱 안정하다는 사실을 보여줍니다.
벤젠의 특징을 한눈에 정리해 보면 아래와 같습니다.
- 정육각형이다. (Hexagonal shape)
- 120도의 결합 각도를 가진다.(Bond angle of 120º)
- 탄소 간의 모든 결합의 길이와 힘이 같다.(Same bond length and strength for all carbon-carbon bonds)
- 1,2 - disubstituted benzene은 하나의 이성질체를 가진다(only one isomer for 1,2-disubstitued benzene)
- 평면이다.(Planar)
- 첨가반응이 일어나지 않는다(No addition reaction)
- Cyclohex-1,3,5-triene 보다 수소화 엔탈피의 발열량이 더 적다(Enthlapy of hydrogenation is less exothermic than Cyclohex-1,3,5-triene)
이것으로 10단원 SL파트는 끝이 났습니다. 마지막으로 이번 포스팅에서 다룬 내용과 관련된 문제들과, 10.2단원에서 나온 대부분의 반응을 한 번에 담은 도표를 첨부하겠습니다.

1) 벤젠의 공명 구조를 증명하는 근거를 1가지 서술하시오. (State an evidence for the resonance structure of benzene.)
2) Butan-2-ol을 산화시킨 생성물을 고르시오.(What is the product of the oxidation of butan-2-ol?)
A. But-2-ene
B. Butanoic acid
C. Butanal
D. Butanone
3) 수산화나트륨과 2-chlorobutane의 반응의 생성물을 고르시오. (What is the organic product of the reaction between 2-chlorobutane and sodium hydroxide solution?)
A. Butan-1-ol
B. Butan-2-ol
C. Butanal
D. Butanone
4) 할로젠과 친전자 치환 반응을 하는 물질을 고르시오. (Which will react with a halogen by an electrophilic substitution mechanism?)

정답)
1)
- 1,2-disubstituted 벤젠은 하나의 이성질체만을 가진다.
- 벤젠의 수소화 엔탈피는 Cyclohex-1,3,5-triene보다 발열량이 적다.
- 친전자 치환 반응을 거친다/첨가 반응을 하지 않는다/브롬수의 색을 투명하게 바꾸지 못한다
(- Only one isomer for 1,2-disubstituted benzene
(- Enthalphy of hydrogeneation of benzene is less exothermic than Cyclohex-1,3,5-triene)
(- Undergoes electrophilic substitution reaction/Does not undergo addition reaction/Does not decolorize bromine water)
2) D.
3) B.
4) A.